Eine dreijährige, von Prüfern geleitete prospektive Studie an japanischen Patienten mit einer Impella Herzpumpe stellte beim Einsatz von Impella bei Patienten mit kardiogenem Schock im Rahmen eines akuten Herzinfarkts nach 30 Tage eine Überlebensrate von 77 % fest. Die historische Überlebensrate bei einem kardiogenen Schock beträgt etwa 50 %. Die Studie unter Aufsicht von 10 japanischen Fachgesellschaften, einschließlich der Japanese Circulation Society (JCS), verwendete erstmals das Japanese Registry for Percutaneous Ventricular Assist Devices (J-PVAD) zur Untersuchung der Wirksamkeit und Sicherheit von Impella. Die J-PVAD-Daten werden unabhängig überwacht und an die japanische Behörde für Arzneimittel und Medizinprodukte (PMDA) weitergeleitet. Der Studienleiter, Yoshiki Sawa M.D., Ph.D., stellte die Interimsanalyse heute als brandaktuelle klinische Studie auf der jährlichen wissenschaftlichen Tagung der JCS vor.
Diese Pressemitteilung enthält multimediale Inhalte. Die vollständige Mitteilung hier ansehen: https://www.businesswire.com/news/home/20200803005503/de/
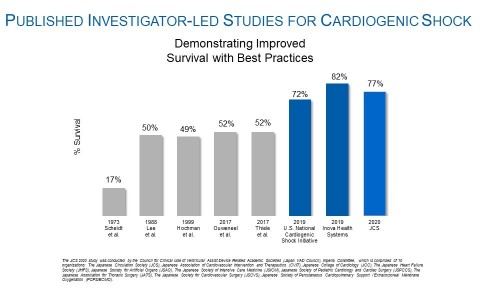
Figure 1 (Graphic: Business Wire)
In der Interimsanalyse wurden 819 Patienten untersucht, die wegen verschiedener Beschwerden an 109 japanischen Krankenhäusern mit Impella behandelt wurden, darunter kardiogener Schock und fulminante Herzmuskelentzündung. Außerdem zeigte die Studie die hohe Wirksamkeit von Impella bei fulminanter Herzmuskelentzündung, mit einer Überlebensrate von 88 % nach 30 Tagen. Insgesamt kamen die Prüfer zu dem Schluss, dass die positiven Überlebensdaten nach 30 Tagen auf den Nutzen der Therapie mit Impella hinweisen.
„Diese Daten zeigen, dass der frühzeitige Einsatz von Impella bei Patienten mit akutem Herzversagen, die nicht auf eine medikamentöse Therapie ansprechen, durchgehend hohe Überlebensraten und eine native Erholung des Herzens bei kardiogenem Schock und anderen lebensbedrohlichen Krankheitsbildern erzielen kann“, so Dr. Sawa, Professor an der Abteilung für kardiovaskuläre Chirurgie an der Fakultät für Humanmedizin an der Universität Osaka und Vorsitzender der Japanese Association of Thoracic Surgery. „Dies wurde durch die genaue Befolgung der Best Practices für den Einsatz von Impella ermöglicht. Ich danke meinen Kollegen an den japanischen Kliniken, dass sie die Protokolle und Hinweise des Impella Committee zur sicheren Einführung einer neuen Behandlung beachtet haben – zum Wohle unserer Patienten.“
Eine frühere Untersuchung der Überlebensrate bei kardiogenem Schock in Japan durch Ueki et al. (Circulation 2015) stellte eine 30-Tage-Überlebensrate von 32 % bei Patienten fest, die mit venös-arterieller extrakorporaler Membranoxygenierung (V-A ECMO) behandelt wurden. Die vergleichsweise hohe Überlebensrate mit Impella wurde durch die Befolgung etablierter Best Practices erreicht. Dazu gehören das Einsetzen von Impella vor der PCI, die frühzeitige Erkennung eines kardiogenen Schocks, ein Rechtsherzkatheter und der reduzierte Einsatz von positiv inotropen Medikamenten. Die Ergebnisse der Studie im Hinblick auf Best Practices stimmen mit denen anderer veröffentlichter von Prüfern geleiteter Studien überein, wie der National Cardiogenic Shock Initiative Study (NCSI) sowie der Inova-Studie von Tehrani et al., die eine deutliche Erhöhung der Überlebensrate bei Anwendung der Best Practice-Protokolle für Impella zeigten (siehe Abbildung 1).
„Diese vielversprechende Studie zeigt, dass sich bei Befolgung bekannter Best Practices für den Einsatz von Impella eine deutliche Erhöhung der Überlebensraten bei kardiogenem Schock erzielen läßt“, so William O’Neill, M.D., Medical Director des Center for Structural Heart Disease am Henry Ford Hospital und Projektleiter der NCSI-Studie. „Ich möchte Ärzte weltweit auf die japanischen Daten aufmerksam machen, die für einen frühzeitigen Einsatz von Impella bei Patienten mit kardiogenem Schock sprechen.“
In einem Online-Video zeigen Dr. Sawa und Chuck Simonton, M.D., Chief Medical Officer von Abiomed, wie die japanischen Ärzte durch den Einsatz von Impella und Best Practices die hohen Überlebensraten erzielen konnten. Das Video kann über diesen Link angesehen werden.
Die Wiederherstellung der Herzfunktion mit Impella ist eine kostengünstige Therapie, was in Japan, einem Land mit nur wenigen Herztransplantationen, besonders wichtig ist. Die J-PVAD Register-Studie wird überwacht vom Council for Clinical Use of Ventricular Assist Device Related Academic Societies (Japan VAD Council), Impella Committee, das aus 10 Organisationen besteht:
- Japanese Circulation Society (JCS)
- Japanese Association of Cardiovascular Intervention and Therapeutics (CVIT)
- Japanese College of Cardiology (JCC)
- Japanese Heart Failure Society (JHFS)
- Japanese Society for Artificial Organs (JSAO)
- Japanese Society of Intensive Care Medicine (JSICM)
- Japanese Society of Pediatric Cardiology and Cardiac Surgery (JSPCCS)
- Japanese Association for Thoracic Surgery (JATS)
- Japanese Society for Cardiovascular Surgery (JSCVS)
- Japanese Society of Percutaneous Cardiopulmonary Support / Extracorporeal Membrane Oxygenation (PCPS/ECMO)
Die Impella Herzpumpe wird von Abiomed (NASDAQ: ABMD) hergestellt. Sie ist das am besten untersuchte mechanische Kreislaufunterstützungssystem in der Geschichte der amerikanischen Gesundheitsbehörde FDA, mit FDA-Studien, klinischen Daten von über 125 000 Patienten und mehr als 650 von Experten geprüften Veröffentlichungen aus über 14 Jahren.
ÜBER IMPELLA HERZPUMPEN
Die Geräte Impella 2.5® und Impella CP® haben die PMA-Zulassung der US-amerikanischen Arzneimittelbehörde FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen erhalten, die sich einer elektiven und dringlichen perkutanen Koronarintervention (PCI), wie etwa einer Stentimplantation oder Ballonangioplastie, unterziehen, um verstopfte Koronararterien freizumachen. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5® mit Smart Assist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Die Impella RP® ist von der FDA zur Behandlung von Rechtsherzinsuffizienz oder -dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, einem Myokardinfarkt, einer Herztransplantation oder einer Operation am offenen Herzen zugelassen. Das Impella-RP-System darf außerdem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden rechtsventrikulären Unterstützung für die Dauer von bis zu 14 Tagen bei Intensivpatienten mit einer Körperoberfläche von ≥ 1,5 m2 zur Behandlung einer akuten Rechtsherzinsuffizienz oder Dekompensation aufgrund von Komplikationen im Zusammenhang mit der Coronavirus-Erkrankung 2019 (COVID-19), einschließlich Lungenembolie (PE), eingesetzt werden. Das Impella-RP-System ist weder für die Behandlung der akuten Rechtsherzinsuffizienz noch für die Behandlung der Dekompensation aufgrund von Komplikationen im Zusammenhang mit COVID-19 freigegeben oder zugelassen. Die Impella RP wurde von der FDA im Rahmen einer EUA für einen oben bezeichneten Notfalleinsatz nur für die Dauer der Erklärung, dass Umstände vorliegen, die die Notfallgenehmigung medizinischer Geräte gemäß Abschnitt 564(b)(1) von Act. 21 U.S.C. § 360bbb-3(b)(1) begründen, zugelassen, es sei denn, die Zulassung wird früher beendet oder widerrufen.
In Japan wird die Impella Herzpumpe bei folgenden Indikation eingesetzt: Bei der Behandlung eines medikamentenresistenten akuten Herzversagens aufgrund von kardiogenen Schock oder ähnlichen Ursachen wird ohne chirurgisches Eröffnen des Brustkorbs ein Katheter perkutan/transvaskulär eingeführt. Blut wird über die Spitze eines in die linke Herzkammer eingeführten/platzierten Katheters angesaugt und über die Auslassöffnung, die sich in der aufsteigenden Aorta befindet, herausgepumpt, was eine antegrade Blutzirkulation im Körper unterstützt. Dadurch soll die Hämodynamik und Erholung des Herzmuskels auf minimalinvasive Weise durch eine schnelle Unterstützung des antegraden Blutflusses verbessert werden. Gleichzeitig erfolgt eine Entlastung des Herzmuskels, durch die eine sofortige Wiederherstellung der Herzfunktion erreicht wird.
In Europa sind Impella 2.5, Impella CP und Impella CP mit SmartAssist für eine bis zu fünftägige Behandlung von Hochrisiko-PCI- und AMI-Patienten mit kardiogenem Schock CE-zertifiziert. Impella 5.0 und Impella LD sind CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten bei kardiogenem Schock bis zu 10 Tage lang zu behandeln. Die Impella 5.5 mit Smart Assist ist CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten bei kardiogenem Schock bis zu 30 Tage lang zu behandeln. Die Impella RP ist CE-gekennzeichnet, um Rechtsherzversagen oder -dekompensation nach Implantation des linksventrikulären Unterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktäre ventrikuläre Arrhythmie zu behandeln. Nähere Informationen über die Impella-Herzpumpenplattform, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen zur Anwendung der Geräte, finden Sie unter www.impella.com.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens die Erholung des Herzens ermöglichen. Weitere Informationen finden Sie unter www.abiomed.com. Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist und Impella Connect sind eingetragene Marken von Abiomed, Inc. und in den USA und bestimmten anderen Ländern eingetragen. Impella BTR, Impella ECP, CVAD Study und STEMI DTU Study sind angemeldete Marken von Abiomed, Inc.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter auch in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von Abiomed, das kommerzielle Wachstum des Unternehmens, zukünftige Geschäftsmöglichkeiten und ausstehende regulatorische Genehmigungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, darunter Unwägbarkeiten im Zusammenhang mit Umfang, Ausmaß und Dauer der Auswirkungen der COVID-19-Pandemie, mit der Entwicklung, Prüfung und damit verbundenen regulatorischen Genehmigungen, einschließlich der Möglichkeit künftiger Verluste, mit komplexer Herstellung, hohen Qualitätsanforderungen, Abhängigkeit von begrenzten Bezugsquellen, Wettbewerb, technologischen Veränderungen, staatlichen Auflagen, Rechtsstreitigkeiten, künftigem Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie anderen Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission (SEC) hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und der nachfolgend bei der SEC eingereichten Unterlagen, dargelegt werden. Den Lesern dieser Pressemitteilung wird geraten, zukunftsgerichtete Aussagen, die ausschließlich den Informationsstand am Tag der Veröffentlichung widerspiegeln, nicht als verlässliche Informationen zu bewerten. Das Unternehmen ist nicht dazu verpflichtet, Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch die Einwirkung unvorhersehbarer Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Originalversion auf businesswire.com ansehen: https://www.businesswire.com/news/home/20200803005503/de/

