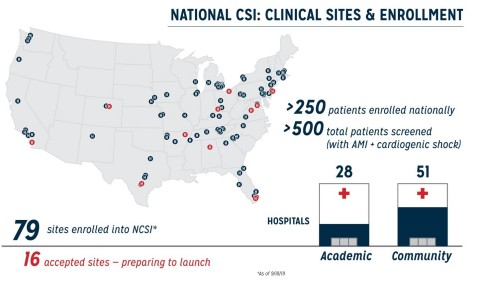
Die heute vorgestellten Daten aus der National Cardiogenic Shock Initiative Study (NCSI) mit 250 Patienten in 49 Zentren, die einen akuten Myokardinfarkt mit kardiogenem Schock (AMICS) erlitten haben, belegen eine Überlebenschance von 72 % mit 98-prozentiger Wiederherstellung der nativen Herzfunktion zum Zeitpunkt der Entlassung. Die Patienten wurden gemäß NCSI-Protokoll behandelt, demzufolge Abiomeds (NASDAQ: ABMD) Impella-Herzpumpe vor der Revaskularisierung durch perkutane Koronarintervention (PCI) eingebracht wird. Die Studie zeigt die Reproduzierbarkeit des protokollbasierten Ansatzes zur Erhöhung der Überlebensraten bei kardiogenem Schock in Universitätskliniken und Gemeindekrankenhäusern in den Vereinigten Staaten. Die Ergebnisse wurden von William O'Neill, MD, Medical Director des Center for Structural Heart Disease am Henry Ford Hospital auf der 31. Transcatheter Cardiovascular Therapeutics (TCT) Conference in San Francisco vorgestellt.
Diese Pressemitteilung enthält multimediale Inhalte. Die vollständige Mitteilung hier ansehen: https://www.businesswire.com/news/home/20190930005707/de/
(Photo: Business Wire)
Vor Durchführung der NCSI stagnierten die Überlebensraten bei kardiogenem Schock in den letzten 20 Jahren bei rund 50 %. Die Prüfer der ärztlich geleiteten NCSI wenden Protokolle zur Erhöhung der Überlebensrate und Wiederherstellung der nativen Herzfunktion an.
Die NCSI-Protokolle basieren auf bewährten Verfahren wie der frühzeitigen Erkennung eines kardiogenen Schocks, eines nur minimalen Einsatzes von Inotropen und des Einbringens von Impella CP vor der Revaskularisierung (PCI). Der Nachweis, dass sich das Einbringen der Impella vor einer PCI als optimales Verfahren bewährt hat, beruht auf den Daten von mehreren tausend Patienten aus der Impella-IQ-Datenbank, der cVAD-Studie, dem Hannoveraner Register und der Detroit Cardiogenic Shock Initiative.
Die Prüfer planen nun den Einsatz neuer Eskalationsprotokolle, die unmittelbar nach der von Impella unterstützten PCI im Katheterlabor angewendet werden, um das Patientenüberleben und die Wiederherstellung der nativen Herzfunktion weiter zu verbessern. Die Eskalationsprotokolle bauen auf den Erkenntnissen der Cardiogenic Shock Working Group, der cVAD-Studie und ersten NCSI-Daten auf.
Im Folgenden sind die Eskalationsprotokolle aufgeführt:
- Nach einer PCI mit Impella: Wenn der Patient ein Inotrop erhält und einen Cardiac Power Output (CPO) von weniger als 0,8 Watt hat, erfolgt innerhalb von 6 Stunden eine Eskalation zu Impella 5.0.
- Nach einer PCI mit Impella: Wenn der Patient eine rechtsventrikuläre (RV) Dysfunktion aufweist, erfolgt eine schnelle Eskalation zu Impella RP oder Sauerstoffversorgung.
„Durch die frühzeitige Erkennung und entsprechende Therapie-Eskalation bei Patienten, die zusätzliche Unterstützung benötigen, können wir meiner Meinung nach die Überlebensrate bei kardiogenem Schock auf 75 % steigern“, so William O'Neill, MD, Medical Director des Center for Structural Heart Disease am Henry Ford Hospital. „Ärzte im ganzen Land haben bereits nachgewiesen, dass die Verwendung eines standardisierten Protokolls, das den frühzeitigen Einsatz der Impella-Herzpumpe beinhaltet, das Überleben und die Wiederherstellung der nativen Herzfunktion erheblich verbessern kann. Diese neuen Eskalationsprotokolle können dazu beitragen, dass noch mehr Patienten nach Hause zu ihren Familien zurückkehren können.“
Seit Erhalt der FDA-Zulassung hat Abiomed Beobachtungsdaten zu fast 100 % der US-amerikanischen Patienten mit einer Impella-Pumpe in der IQ-Datenbank gesammelt. In Verbindung mit den in der prospektiven cVAD-Studie von Abiomed eingebetteten Studien nach der FDA-Zulassung unterstützen diese klinischen Daten die Identifizierung und Validierung von bewährten Verfahren für den Einsatz von Impella in Verbindung mit höheren Überlebensraten und der Wiederherstellung der nativen Herzfunktion.
„Der kardiogene Schock ist durch eine kritische Endorganhypoperfusion gekennzeichnet und die FDA hat die Entlastung durch Impella als Therapie für Patienten zugelassen“, sagte Seth Bilazarian, MD, Chief Medical Officer von Abiomed. „Protokolle mit Nachweisen aus der klinischen Praxis, die in mehreren Registern und Studien gesammelt wurden, zeigen, dass die Entlastung mit Impella vor einer PCI eine entscheidende Komponente für die Erhöhung der Überlebenschance bedeutet.“
Impella hat die höchste Zulassungsstufe der FDA als Therapie bei kardiogenem Schock, die das Ziel verfolgt, die ventrikuläre Belastung zu reduzieren und den Kreislauf so zu unterstützen, dass sich das Herz erholen und die verbleibende Myokardfunktion frühzeitig evaluiert werden kann.
ÜBER DIE IMPELLA-HERZPUMPEN
Die Geräte Impella 2.5® und Impella CP® haben die PMA-Zulassung von der FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen, die sich einer elektiven oder dringlichen perkutanen Koronarintervention (PCI: Percutaneous Coronary Intervention) wie etwa einer Stentimplantation oder Ballonangioplastie unterziehen, um blockierte Koronararterien freizumachen. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5™ mit Smart Assist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkten oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Impella RP® ist von der US-amerikanischen Zulassungsbehörde FDA zur Behandlung von Rechtsherzinsuffizienz oder Dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, Myokardinfarkt, Herztransplantation oder Operation am offenen Herzen zugelassen. Impella ist das am intensivsten erforschte mechanische Kreislaufunterstützungssystem in der Geschichte der FDA mit Daten aus der klinischen Praxis zu über 100.000 Patienten und mehr als 550 Peer-Review-Veröffentlichungen.
In Europa besitzen Impella 2.5, Impella CP und Impella CP mit SmartAssist die CE-Kennzeichnung für eine bis zu fünftägige Behandlung von Hochrisiko-PCI- und AMI-Patienten, die einen kardiogenen Schock erlitten haben. Impella 5.0 und Impella LD haben die CE-Kennzeichnung für eine bis zu zehntägige Behandlung von Patienten mit Herzinfarkt oder Kardiomyopathie mit kardiogenem Schock. Die Herzpumpe Impella 5.5™ mit Smart Assist® ist CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock bis zu 30 Tage lang zu behandeln. Die Impella RP ist eine mit der CE-Kennzeichnung versehene Herzpumpe zur Behandlung von Patienten mit Rechtsherzversagen oder Dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktärer ventrikulärer Arrhythmie.
Nähere Informationen über die Impella-Herzpumpenplattform, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen zur Anwendung der Geräte, finden Sie unter www.impella.com.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens die Erholung des Herzens ermöglichen. Weitere Information finden Sie unter www.abiomed.com.
Abiomed, Impella, Impella 2.5, Impella 5.0, Impella LD, Impella CP, Impella RP und Impella Connect sind eingetragene Marken von Abiomed, Inc. und in den USA und in bestimmten anderen Ländern eingetragen. Impella BTR, Impella 5.5, Impella ECP, CVAD Study und SmartAssist sind angemeldete Marken von Abiomed, Inc.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter Aussagen in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von Abiomed, das kommerzielle Wachstum des Unternehmens, zukünftige Geschäftsmöglichkeiten und ausstehende regulatorische Zulassungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen dargestellten Erwartungen unterscheiden, darunter Unsicherheiten in Verbindung mit der Entwicklung, Prüfung und damit verbundenen regulatorischen Zulassungen, einschließlich der Möglichkeit künftiger Verluste, komplexe Herstellung, hohe Qualitätsanforderungen, Abhängigkeit von begrenzten Versorgungsquellen, Wettbewerb, technologische Veränderungen, staatliche Auflagen, Rechtsstreitigkeiten, künftiger Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie andere Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und des aktuellen Quartalsberichts auf Formblatt 10-Q, näher ausgeführt werden. Leser werden darauf hingewiesen, sich nicht über Gebühr auf solche zukunftsgerichteten Aussagen zu verlassen, da diese nur für den Zeitpunkt dieser Pressemitteilung gelten. Das Unternehmen ist nicht dazu verpflichtet, Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch das Eintreten unvorhergesehener Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Originalversion auf businesswire.com ansehen: https://www.businesswire.com/news/home/20190930005707/de/

